Évidence clinique
Indications principales
Les résultats des essais pertinents pour ces entités sont décrits ci-dessous.
Cancer du sein locorégional récurrent
Le cancer du sein est le cancer le plus fréquent chez les femmes dans le monde entier et la récidive locorégionale peut survenir chez un tiers des patientes déjà traitées.1 Le traitement des récidives locorégionales du cancer du sein peut comprendre une chirurgie et une radiothérapie ou une nouvelle radiothérapie chez les patientes qui ont déjà subi une radiothérapie lors de leur traitement initial.
Une métaanalyse récente a analysé huit études à deux bras, dont cinq essais randomisés, portant sur un total de 627 patients ayant subi une radiothérapie seule ou une radiothérapie combinée à une hyperthermie superficielle à base de micro-ondes.1 Les patients ont été traités avec une médiane de 7 séances d’hyperthermie, atteignant une température moyenne de 42,5 °C. La dose moyenne de radiothérapie était de 38,2 Gy (de 26 à 60 Gy). L’hyperthermie a été appliquée le plus souvent après la radiothérapie. Le taux de réponse complète du traitement combiné a été de 60,2 %, soit une amélioration significative par rapport à 38,1 % après la radiothérapie seule (odds ratio 2,64, intervalle de confiance à 95 % 1,66–4,18, P<0,0001). Le profil de toxicité aiguë et tardive du traitement combiné était faible.1
Référence :
Cancer du col de l’utérus localement Avancé
Le cancer du col de l’utérus est le quatrième cancer le plus fréquent chez les femmes.
On dispose des résultats à long terme d’un essai randomisé comparant la radiothérapie utilisant une dose totale médiane de 68 Gy (y compris un boost de curiethérapie) et un total de 5 séances d’hyperthermie régionale (42 °C pendant une période de 60 minutes) à la radiothérapie seule chez 114 patientes atteintes d’un cancer du col de l’utérus à un stade localement avancé1. L’essai a démontré des améliorations soutenues de son critère d’évaluation principal, à savoir le contrôle local pour le traitement combiné (56 % contre 37 % ; p = 0,01), ainsi qu’une amélioration de la survie globale après 12 ans : 37 % contre 20 % (p = 0,03) avec des événements de toxicité tardive de grade 3 similaires dans les deux groupes.1
Pour le cancer du col de l’utérus localement avancé, la chimioradiation combinée est une norme de soins. On ne sait pas vraiment si l’hyperthermie peut également améliorer les résultats de la chimioradiothérapie. Par conséquent, l’association de l’hyperthermie et de la radiothérapie est recommandée principalement pour les patientes qui ne sont pas aptes ou qui ne veulent pas subir de chimiothérapie.
Une récente méta-analyse en réseau de 59 essais randomisés a suggéré une efficacité égale de l’association hyperthermie-radiothérapie par rapport à la chimioradiothérapie dans le cas du cancer du col de l’utérus localement avancé.2
Références :
Cancer du pancréas
Le cancer du pancréas est l’une des causes les plus fréquentes de décès liés au cancer dans le monde. La seule option thérapeutique curative est la résection chirurgicale, qui n’est applicable qu’à environ un tiers des patients nouvellement diagnostiqués. Après la résection, une chimiothérapie adjuvante est indiquée.
Les résultats de l’"Hyperthermia European Adjuvant Trial" (HEAT) sont disponibles. Il s’agit d’un essai clinique randomisé qui a comparé l’hyperthermie régionale (RHT) avec le cisplatine ajouté à la gemcitabine à la chimiothérapie avec la gemcitabine seule dans le traitement adjuvant après résection d’un cancer du pancréas.1
Au total, 117 patients ont été randomisés et ont reçu, dans le groupe expérimental, de la gemcitabine 1000 mg/m2 les jours 1 et 15 et du cisplatine 25 mg/m2 avec RHT les jours 2, 3 et 16, 17 (n= 57). Dans le groupe témoin, la gemcitabine 1000 mg/m2 a été administrée les jours 1, 8 et 15 (n=60). Le traitement adjuvant a été administré toutes les quatre semaines et les patients ont reçu six cycles de traitement. L’essai a été interrompu prématurément en mai 2018, lorsque le schéma FOLFIRINOX modifié a remplacé la gemcitabine comme traitement standard.
Alors que l’essai HEAT n’a pas montré de différence significative en termes de survie sans maladie (12,7 vs. 11,2 mois ; p = 0,394), les résultats montrent une amélioration significative de la survie après récidive dans le bras expérimental (15,3 vs. 9,8 mois ; p = 0,031). En cas de récidive, le m-FOLFIRINOX ou le nab-paclitaxel plus gemcitabine ont été utilisés chez la plupart des patients, ce qui n’était pas différent entre les bras de l’essai. En outre, une tendance à l’amélioration de la survie globale de 33,2 contre 25,2 mois (p = 0,099) a été observée, avec des taux de survie à 5 ans de 28,4 % contre 18,7 %, respectivement. Les incidents indésirables selon le grade CTCAE ≥ 3 n’ont pas différé de manière significative entre les groupes (61,5 % vs. 63,6 %) et la toxicité a été plus faible qu’avec la chimiothérapie adjuvante intensifiée avec FOLFIRINOX modifié.

Référence :
TUMEURS GERMINALES MALIGNES NON TESTICULAIRES RÉFRACTAIRES OU RÉCIDIVANTES CHEZ LES ENFANTS ET ADOLESCENTS
Les tumeurs germinales malignes pédiatriques sont rares, représentant environ 3 à 4 % de toutes les tumeurs malignes chez les enfants et plus de 50 % sont diagnostiquées chez les nourrissons et les enfants en bas âge de moins de 4 ans.1 La polychimiothérapie à base de cisplatine permet de guérir jusqu’à 90 % des patients, mais environ 10 % d’entre eux présentent une maladie réfractaire ou récurrente.
Une étude de phase 2 ouverte, non randomisée, menée dans un seul établissement, a testé le traitement combiné de 3 à 4 cycles de chimiothérapie à base de cisplatine, d’étoposide et d’ifosfamide (tous appliqués du 1er au 4ème jour) associé à une hyperthermie régionale (1er et 4ème jour de chaque cycle, 60 minutes à 42°C) chez 44 patients atteints de tumeurs germinales malignes pédiatriques réfractaires ou récidivantes.1 Sur l’ensemble des patients, 86% ont eu une réponse objective au traitement. La survie sans événement à 5 ans était de 62% (95% CI 4–5), et la survie globale à 5 ans était de 72% (95% CI 5–3).1 Le pronostic à long terme des patients ayant une faible réponse ou après une première rechute était presque similaire à celui des patients recevant un traitement de première ligne. Les données de cet essai suggèrent donc que l’hyperthermie peut servir à améliorer la chimiorésistance.1
Référence :
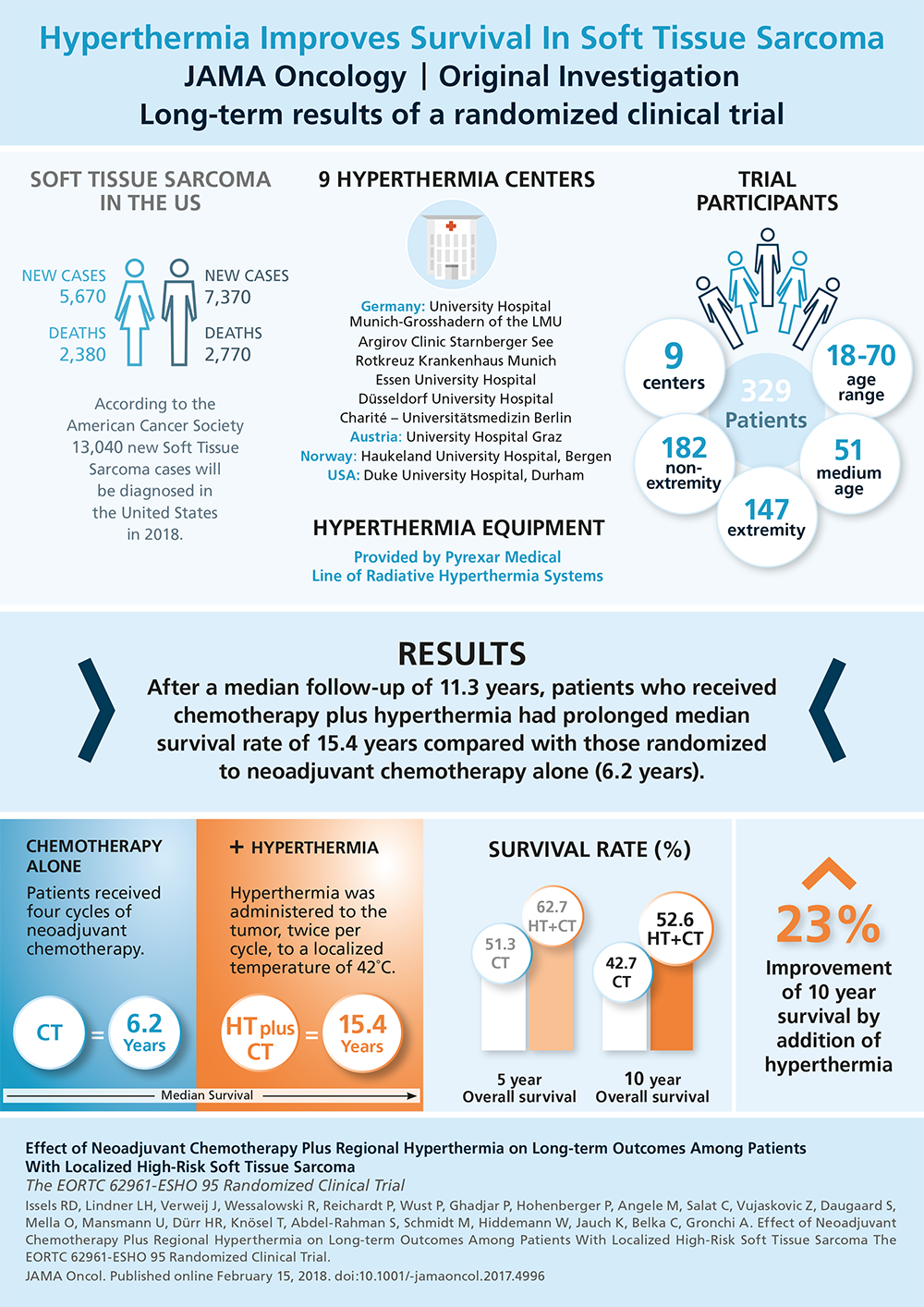
Sarcome des tissus mous á haut risque
Le sarcome des tissus mous est une maladie relativement rare qui représente moins de 1 % de tous les cas de cancer. La chirurgie et la radiothérapie néoadjuvante ou adjuvante représentent la norme de soins pour les sarcomes des tissus mous à haut risque, la chimiothérapie périopératoire étant une option de traitement supplémentaire.
Les résultats à long terme d’une étude randomisée sont disponibles et comparent la chimiothérapie périopératoire (utilisant la doxorubicine, l’ifosfamide et l’étoposide, 4 cycles néoadjuvants, 4 cycles adjuvants) plus l’hyperthermie régionale à la chimiothérapie périopératoire seule chez 341 patients atteints d’un sarcome primaire ou localement récurrent à haut risque des tissus mous du tronc et des extrémités.1,2 La radiothérapie adjuvante a été administrée à raison de 5–6 Gy et il n’y a pas eu de différence entre les deux groupes en ce qui concerne l’utilisation de la radiothérapie. L’hyperthermie (42°C pendant 60 minutes) a été administrée en même temps que l’ifosfamide au jour 1 et au jour 4 de chaque cycle de chimiothérapie. Par rapport à la chimiothérapie seule, l’ajout de l’hyperthermie régionale a amélioré le critère d’évaluation principal de cet essai, à savoir la survie sans progression locale (rapport de risque, 0,65 ; IC à 95 %, 0,4–,86 ; P = 0,002). En outre, les patients randomisés pour recevoir une chimiothérapie plus une hyperthermie régionale avaient des taux de survie globale prolongés par rapport à ceux randomisés pour recevoir une chimiothérapie seule (rapport de risque, 0,73 ; IC à 95 %, 0,5–,98 ; P = 0,04) avec une survie à 5 ans de 62,7 % (IC à 95 %, 55,2 %-70,1 %) contre 51,3 % (IC à 95 %, 43,7 %-59,0 %), respectivement, et une survie à 10 ans de 52,6 % (IC à 95 %, 44,7 %-60,6 %) contre 42,7 % (IC à 95 %, 35,0 %-50,4 %).2
Références :
